Cet article explique ce qu'est un calorimètre et à quoi il sert. De plus, vous découvrirez les différents types de calorimètres qui existent et le fonctionnement de cet instrument de mesure.
Qu'est-ce qu'un calorimètre ?
Un calorimètre est un instrument de laboratoire utilisé pour mesurer la quantité de chaleur reçue ou perdue par un corps. De plus, le calorimètre est un instrument utilisé pour déterminer la chaleur spécifique d'une substance.
Par exemple, un calorimètre peut être utilisé pour mesurer l’énergie sous forme de chaleur libérée lors d’une réaction chimique.
Les calorimètres les plus modernes sont capables de travailler dans une large plage de températures, certains peuvent atteindre 3500 K. De plus, actuellement les calorimètres sont très précis, ils peuvent avoir une précision inférieure à 1%, bien que cela dépende des caractéristiques et de la utilisation du calorimètre.
En calorimétrie, les applications du calorimètre sont nombreuses. Les calorimètres peuvent être utilisés pour réaliser une étude biologique, effectuer un contrôle qualité ou même examiner le taux biologique.
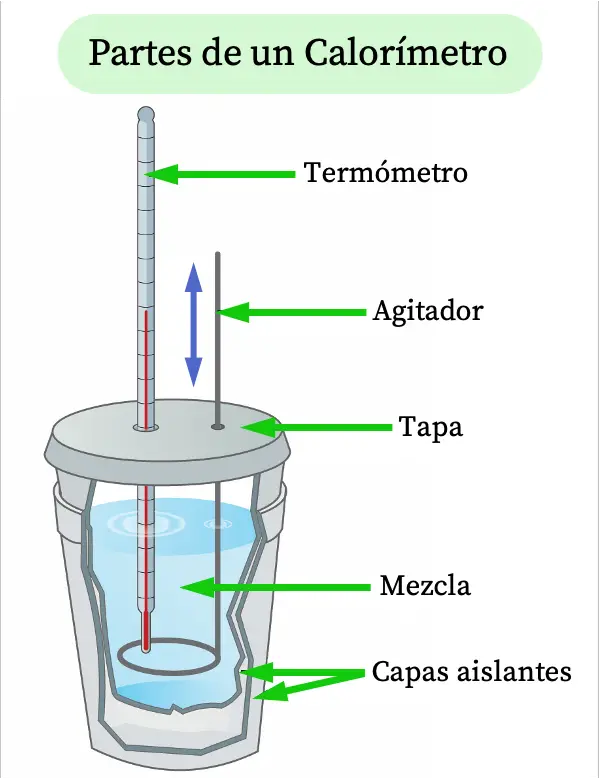
Parties d'un calorimètre
Compte tenu de la définition d'un calorimètre, les parties d'un calorimètre typique sont expliquées ci-dessous :
- Thermomètre : permet de mesurer la température à l'intérieur du calorimètre.
- Agitateur : partie du calorimètre qui est agitée en permanence pour élever la température du mélange.
- Couvercle : couvercle qui peut être ouvert et fermé pour introduire le mélange à étudier.
- Mélange : c'est la substance dont on veut faire une analyse calorifique.
- Couches isolantes : le récipient du calorimètre doit isoler thermiquement le mélange de l'extérieur, afin que la température ambiante ne l'influence pas. C'est pourquoi ils sont généralement constitués de deux couches d'isolation thermique, généralement en polystyrène.
Types de calorimètres
Les différents types de calorimètres sont les suivants :
- Calorimètre adiabatique : les calorimètres adiabatiques sont utilisés pour étudier les réactions adiabatiques isolées, c'est-à-dire que l'échange de chaleur avec l'extérieur ne peut pas se produire. Cependant, une certaine quantité de chaleur est toujours perdue, c'est pourquoi un facteur de correction est généralement appliqué pour compenser.
- Calorimètre à réaction – Un processus chimique se déroule à l’intérieur du calorimètre, qui est fermé et isolé. En général, il est utilisé pour déterminer la chaleur dégagée par une réaction ; il est également utilisé dans les réactions qui nécessitent une température constante.
- Calorimètre à flux thermique – Avec ce type, une enveloppe de chauffage/refroidissement contrôle la température du processus physique. La chaleur de réaction est déterminée en mesurant la différence de température entre le fluide caloporteur et le fluide de procédé. Ils sont moins précis que les autres types de calorimètres.
- Calorimètre à bilan thermique : Ce type de calorimètre nécessite également une enveloppe chauffante/refroidissante pour contrôler la température du procédé. La chaleur est mesurée en surveillant la chaleur gagnée ou perdue par le fluide de transfert.
- Calorimètre à compensation d'énergie : dans ce cas, un chauffage ajouté au récipient est utilisé pour maintenir une température constante. L'énergie du chauffage peut être ajustée en fonction des besoins de la réaction.
- Calorimètre à débit constant – Ce type de calorimètre maintient un flux constant de chaleur à travers la paroi du récipient.
- Calorimètre à bombe : Ce type de calorimètre est utilisé pour calculer la chaleur de combustion. Il est courant qu’une étincelle électrique soit appliquée pour enflammer le carburant. De plus, ils travaillent à des pressions très élevées.
- Calorimètre type Calvet : ces calorimètres utilisent un capteur de débit 3D. Ils conviennent bien aux échantillons de grande taille car ils permettent d’utiliser une plus grande taille de récipient de réaction.
- Calorimètre à pression constante : Ce type de calorimètre est utilisé pour mesurer le changement de chaleur dans une solution sous pression constante.
- Calorimètre à balayage différentiel – Il existe généralement deux plateaux, un plateau d'échantillons et un plateau de référence. Le plateau d'échantillons contient l'échantillon tandis que le plateau de référence reste vide. Chaque récipient est chauffé séparément à un rythme spécifique, et ce rythme est maintenu tout au long de l'expérience. Cependant, un système informatique veille à ce que chaque casserole chauffe au même rythme, afin qu'une mesure puisse être prise. Le chauffage situé sous le plateau d'échantillons doit travailler plus fort que le plateau de référence vide, ce qui signifie qu'il produit plus de chaleur. Ainsi, le calorimètre effectue la mesure en fonction de la différence de quantité de chaleur émise dans les plateaux.
- Calorimètre de titrage isotherme – Dans ce type, la chaleur de réaction est utilisée pour suivre une expérience de titrage. Il est possible de déterminer le point médian de la réaction, son enthalpie et son affinité de liaison. Ce type de calorimètre est très utile dans l’industrie pharmaceutique pour classer les candidats médicaments potentiels.
Comment fonctionne un calorimètre
Comme vous l’avez vu dans la section précédente, il existe de nombreux types de calorimètres, chacun fonctionne donc différemment. Ce qui suit explique comment est utilisé le calorimètre adiabatique, car c'est le plus utilisé dans les expériences en laboratoire.
Le fonctionnement du calorimètre repose sur l’agitation du shaker. Avant d'utiliser le shaker, il faut logiquement introduire l'échantillon dans le calorimètre. Et une fois le couvercle fermé pour isoler l'échantillon, il faut déplacer rapidement l'agitateur, par conséquent la température de l'échantillon va monter. Avec le thermomètre, vous pouvez voir la température à laquelle se trouve l'échantillon.
Ensuite, après avoir agité l'échantillon, les mesures pertinentes sont effectuées. Afin que les résultats puissent être comparés aux données mesurées avant de chauffer l’échantillon. Et avec toutes les données collectées lors de l'expérience, des calculs peuvent être effectués, comme la variation d'enthalpie produite dans le processus adiabatique.
Différence entre un calorimètre et un thermomètre
La différence entre un calorimètre et un thermomètre réside dans la quantité thermique qu’ils mesurent. Un calorimètre est utilisé pour mesurer la quantité de chaleur gagnée ou perdue, tandis qu'un thermomètre est utilisé pour mesurer la température d'un corps.
Le calorimètre et le thermomètre sont des instruments courants dans les expériences thermodynamiques. En effet, un calorimètre intègre un thermomètre pour déterminer la température à l’intérieur.