이 기사에서는 화학에서 압축성 계수가 무엇인지 설명합니다. 따라서 압축률(공식)을 계산하는 방법을 알아보고, 또한 모든 가스의 압축률을 쉽게 찾을 수 있는 그래프도 볼 수 있습니다.
압축률이란 무엇입니까?
압축률 이란 동일한 온도와 압력에서 실제 기체의 몰부피와 이상기체의 부피 사이의 관계를 나타내는 계수입니다. 즉, 압축성 계수는 이상 기체의 거동에서 실제 기체의 편차를 나타냅니다.
따라서 압축성 계수는 실제 가스가 이상 가스처럼 거동하는 정도를 아는 데 사용됩니다. 압축률의 값이 1에 가까우면 실제 기체가 이상기체라고 볼 수 있다는 의미입니다.
이상기체에 대한 화학법칙은 크게 단순화되므로 일반적으로 기체를 이상기체로 생각할 수 있기를 원합니다.
일반적으로 압축률의 기호는 대문자 Z입니다.
압축성 계수 공식
압축률 계수는 실제 가스의 몰 부피를 해당 이상 기체의 몰 부피로 나눈 값과 같습니다. 따라서 압축성 계수를 계산하는 공식은 다음과 같습니다.
![]()
이상기체의 몰부피는 이상기체 법칙을 사용하여 계산할 수 있으므로 위의 식은 다음과 동일합니다.
![]()
금:
-
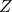
압축성 계수입니다.
-
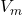
실제 가스의 몰 부피입니다.
-
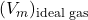
해당 이상 기체의 몰 부피입니다.
-
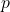
압력이다.
-
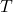
온도입니다.
-
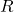
이상기체의 보편적 상수이다.
압축성 계수는 단위가 동일하여 서로 상쇄되는 두 수량을 나누어 계산하므로 단위가 없습니다.
압축률 값이 1에 매우 가까울 때 실제 가스가 이상 가스로 간주될 수 있다고 생각합니다. 일반적으로 우리는 0.95에서 1.05 사이의 값을 사용합니다. 압축률 계수가 1이라는 것은 가스가 이상적이라는 것을 의미하지만 실제로는 완벽하게 이상적인 가스는 없다는 것을 의미합니다.
압축성 계수 그래프
압축성 계수, 감소된 온도 및 감소된 압력은 서로 관련되어 있습니다. 특히 실제 가스의 압축성 계수는 감소된 온도와 압력을 알면 결정할 수 있습니다.
압축성 계수를 찾을 수 있는 그래프는 다음과 같습니다.
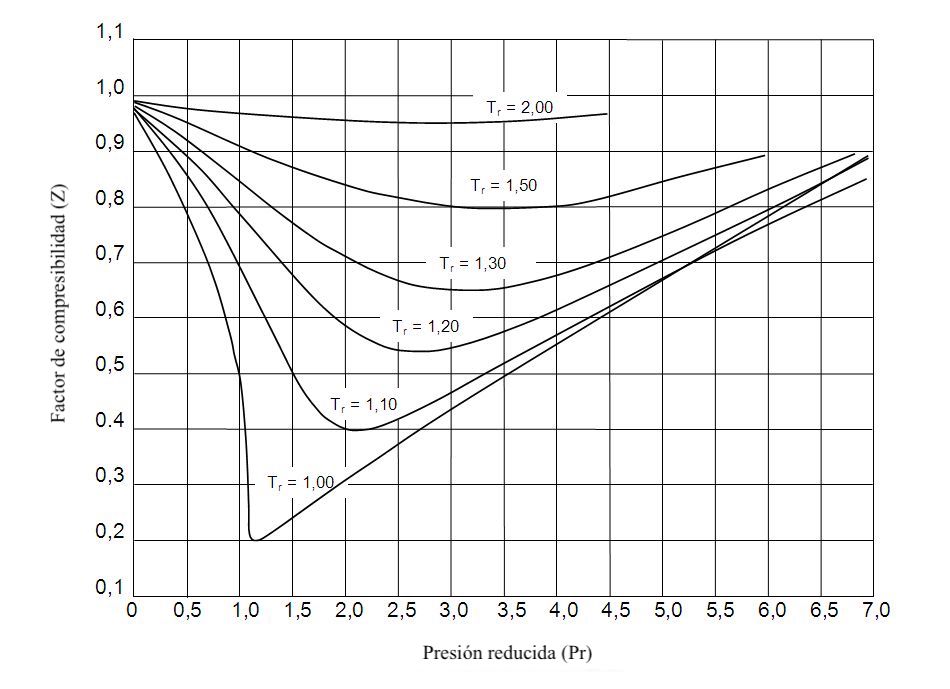
압축성 계수 그래프를 사용하려면 다음 단계를 따라야 합니다.
- 가스의 감소된 압력과 감소된 온도를 계산합니다. 이렇게 하려면 아래 수식을 사용해야 합니다.
- 감소된 가스 압력과 동일한 선을 따라 X축을 따라 그래프를 그립니다.
- 감소된 가스 온도에 해당하는 선을 찾을 때까지 이전 선을 따라 그래프를 뒤로 이동합니다.
- 가스 압축률은 가스의 감소된 압력과 감소된 온도가 교차하는 Y축의 값과 같습니다.
감소된 온도와 감소된 압력은 온도와 압력을 각각 임계 온도와 임계 압력으로 나누어 계산됩니다.
![]()
![]()