この記事では、化学における圧縮率とは何かについて説明します。そこで、圧縮率の計算方法(公式)を確認し、さらに、任意の気体の圧縮率を簡単に見つけることができるグラフを見ることができるようになります。
圧縮率とは何ですか?
圧縮率は、同じ温度および圧力における実在気体のモル体積と理想気体の体積との関係を示す係数です。言い換えれば、圧縮率は、理想気体の挙動からの現実気体の偏差を表します。
したがって、圧縮率は、現実の気体がどの程度理想気体のように動作するかを知るために使用されます。圧縮率の値が 1 に近い場合、実際の気体は理想気体とみなせることを意味します。
理想気体については化学法則が大幅に簡略化されているため、一般に気体を理想気体として考えることができるようにしたいことに注意してください。
一般に、圧縮率の記号は大文字の Z です。
圧縮率係数の式
圧縮率は、実在気体のモル体積を対応する理想気体のモル体積で割ったものに等しくなります。したがって、圧縮率を計算する式は次のようになります。
![]()
理想気体のモル体積は、理想気体の法則を使用して計算できるため、上記の式は次の式と等価です。
![]()
金:
-
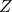
は圧縮率です。
-
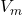
は実際の気体のモル体積です。
-
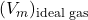
は、対応する理想気体のモル体積です。
-
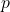
プレッシャーです。
-
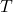
温度です。
-
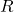
は理想気体の普遍定数です。
圧縮率係数は、同じ単位を持つ 2 つの量を除算することによって計算されるため、単位がありません。したがって互いに打ち消し合います。
圧縮率の値が 1 に非常に近い場合、現実の気体は理想気体であると考えられます。一般に、0.95 ~ 1.05 の値を採用します。圧縮率が 1 に等しいということは、気体が理想的であることを意味しますが、実際には完全に理想的な気体は存在しないことに注意してください。
圧縮率グラフ
圧縮率、減温、減圧は相互に関係しています。具体的には、実際のガスの圧縮率は、その換算温度と圧力がわかっていれば決定できます。
圧縮率を求めるグラフは次のとおりです。
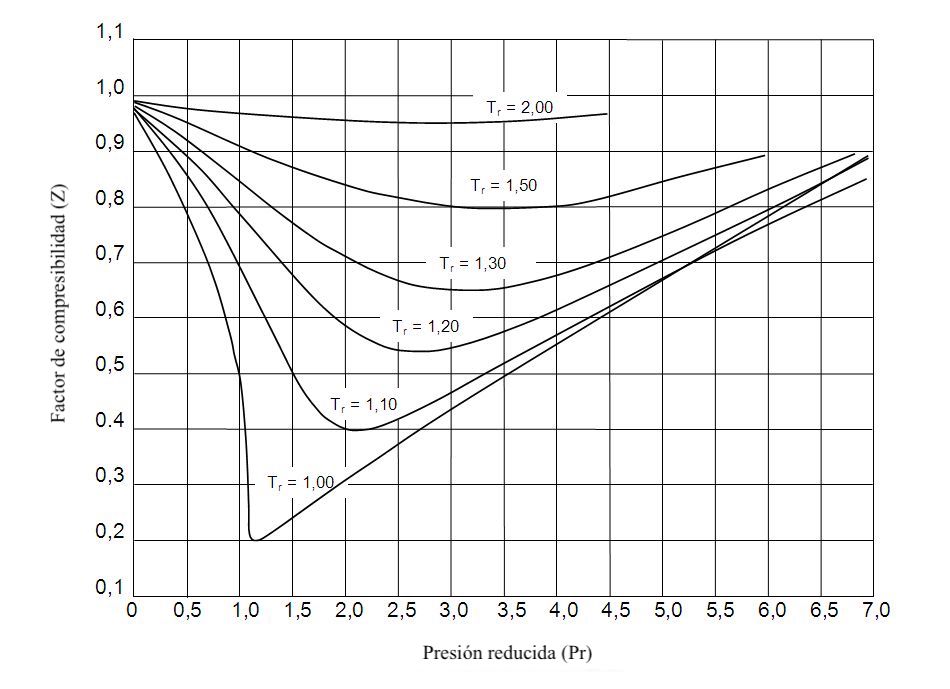
圧縮率グラフを使用するには、次の手順に従う必要があります。
- 気体の減圧と減温を計算します。これを行うには、以下の式を使用する必要があります。
- 減圧されたガス圧力に相当する線に沿って X 軸に沿ってグラフをプロットします。
- 低下したガス温度に対応する線が見つかるまで、グラフを前の線に沿って戻します。
- ガス圧縮率は、ガスの減圧と減温が交差する Y 軸の値に等しくなります。
換算温度と減圧は、それぞれ温度と圧力を臨界温度と臨界圧力で割ることによって計算されることに注意してください。
![]()
![]()